Moleculaire diagnostiek
Snel naar:
Contact:
Boerhaavelaan 59
7555 BB te Hengelo
T 088-5374500
E

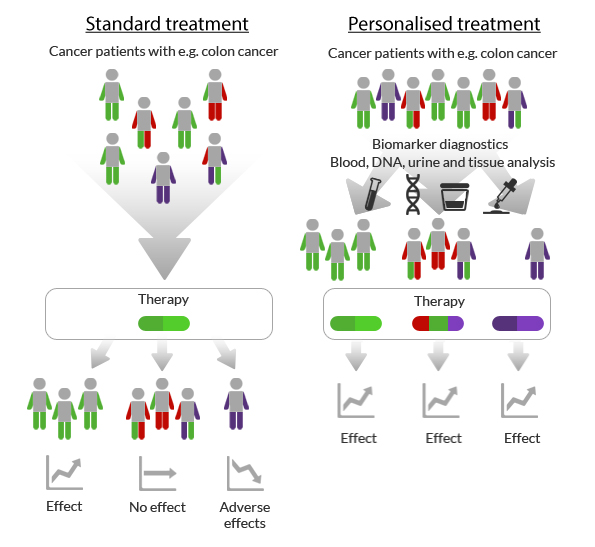
Kanker is een ziekte van het DNA. Beschadigingen aan het DNA van een lichaamscel kunnen ertoe leiden dat deze verandert in een kankercel, die kan uitgroeien tot een tumor. In de moleculaire pathologie wordt het weefsel van de patiënt onderzocht op de aanwezigheid van DNA schade. De schade kan bestaan als mutaties, maar ook als chromosomale afwijkingen of veranderde genexpressies. Op basis van het uitgevoerde moleculaire onderzoek kan met meer zekerheid een uitspraak worden gedaan over de diagnose, de prognose of de slagingskans van beschikbare behandelingen. Door het DNA (of soms het RNA) van de tumor te analyseren op de aanwezigheid van mutaties of chromosomale veranderingen kan meestal een goede inschatting worden gemaakt over de slagingskans van beschikbare behandelingen, de zogenaamde gepersonaliseerde behandelingen. Hiermee wordt voorkomen dat patiënten worden blootgesteld aan behandelingen die naar verwachting weinig effect zullen hebben en waarmee dus tijd (voor de patiënt) en geld (voor de zorg) wordt bespaard. De moleculaire diagnostiek wordt ook gebruikt om met meer zekerheid te kunnen vaststellen of afwijkingen goed- of kwaadaardig zijn en om welke vorm van kanker het gaat. Door de genetische afwijkingen moleculair te onderzoeken, kan in sommige gevallen beter worden voorspeld hoe agressief de tumor is en hoe het ziektebeloop naar verwachting zal zijn. Dit geeft meer duidelijkheid voor de patiënt en voor de behandelend arts. Ook is het mogelijk om te bepalen of er sprake kan zijn van een erfelijke vorm van kanker. Is op basis van het moleculaire onderzoek deze kans aanwezig, dan zal de patiënt meestal worden doorverwezen naar de klinische genetica voor verder genetisch onderzoek, waarbij eventueel ook familieleden van de patiënt in het onderzoek worden meegenomen. Op die manier kan het risico op kanker bij veel mensen vroegtijdig worden getraceerd, met optimale kansen voor de behandeling.
Moleculair onderzoek en Moleculaire technieken
Voor het moleculaire onderzoek wordt het tumorweefsel dat bij de patiënt is afgenomen eerst door de patholoog macro- en microscopisch onderzocht. Op basis van dit onderzoek wordt bepaald of er aanleiding is om moleculair onderzoek te gaan uitvoeren. Hiervoor wordt het meest geschikte tumormateriaal door de moleculair patholoog geselecteerd. De tumorcellen worden door de moleculair analist met behulp van een stereomicroscoop selectief van een glaasje met tumorweefsel afgehaald (microdissectie) en deze cellen worden gebruikt voor de isolatie van het DNA en/of RNA. Het DNA/RNA kan daarna op de aanwezigheid van genetische afwijkingen worden onderzocht, waarbij gebruik wordt gemaakt van moderne moleculaire technieken en innovatieve state-of-the-art analyse apparatuur. De moleculair analisten, moleculair pathologen en de klinisch moleculair bioloog werken daarbij nauw met elkaar samen.


Stereomicroscoop voor microdissectie van tumorcellen.
BENODIGD MATERIAAL
Het moleculaire onderzoek kan worden uitgevoerd op representatief formaline-gefixeerd paraffine-ingebed (FFPE) weefsel, vriesmateriaal of (ingeblokt) cytologiemateriaal met voldoende neoplastische cellen (bij voorkeur minimaal 30% eventueel na microdissectie). De betrouwbaarheid van een negatieve uitslag neemt bij de meeste onderzoeken af bij percentages van neoplastische cellen lager dan 30%.
DOORLOOPTIJD
Alle moleculaire aanvragen worden direct in behandeling genomen. Afhankelijk van het type moleculaire onderzoek hebben de meeste aanvragen een doorlooptijd van 3-5 werkdagen na ontvangst van het materiaal.
Met behulp van moderne, state-of-the-art technieken worden de moleculaire karakteristieken van de tumor bepaald. Voor de isolatie van het DNA/RNA wordt gebruikt gemaakt van geautomatiseerde nucleïnezuur extractie waardoor betrouwbaar, snel en efficiënt zeer zuiver DNA/RNA kan worden geïsoleerd.
 Geautomatiseerde DNA en RNA isolatie uit tumorweefsel
Geautomatiseerde DNA en RNA isolatie uit tumorweefsel
NEXT GENERATION SEQUENCING
Met geavanceerde sequentie analyse technieken kunnen afwijkingen in het DNA en RNA worden opgespoord. De hoeveelheid beschikbaar tumorweefsel voor moleculair onderzoek is vaak erg beperkt, waardoor relatief weinig DNA en RNA materiaal uit de tumor kan worden geïsoleerd. Next Generation Sequencing (NGS) is een zeer efficiënte sequentieanalyse techniek, waarmee met kleine hoeveelheden genetisch materiaal een grote hoeveelheid aan genetische informatie over de tumor verkregen kan worden. Voor analyse van al deze data wordt gebruik gemaakt van gespecialiseerde bio-informatica software, waarmee de sequentieanalyse resultaten inzichtelijk kunnen worden gemaakt en afwijkingen in het tumor DNA betrouwbaar kunnen worden gedetecteerd.
 Illumina NextSeq2000 voor Next Generation Sequencing (NGS)
Illumina NextSeq2000 voor Next Generation Sequencing (NGS)
IN SITU HYBRIDISATIE
Met in-situ hybridisatie (ISH) kunnen genetische afwijkingen als gen-amplificaties en chromosomale herrangschikkingen (deleties, translocaties) worden aangetoond. ISH is een methode om DNA of RNA zichtbaar te maken in het weefsel met de tumorcellen. Het weefsel wordt met enzymen behandeld waardoor de tumorcellen permeabel worden zodat het DNA/RNA in de celkern toegankelijk wordt voor chromogene of fluorescente detectie probes. De celkernen worden tegengekleurd met een kernkleurstof. De chromogene signalen (CISH) worden geanalyseerd met een lichtmicroscoop, fluorescerende signalen (FISH) met een fluorescentiemicroscoop. De analyse wordt ondersteund door geavanceerde beeldanalyse software. Vastgestelde chromosomale afwijkingen kunnen voorspellend zijn voor de responskans van een behandeling (bijv. borstkanker) of helpen bij het vaststellen van de diagnose.
 Computergestuurde beeldanalyse voor detectie van chromosomale afwijkingen
Computergestuurde beeldanalyse voor detectie van chromosomale afwijkingen
HPV GENOTYPERING MET qPCR
Baarmoederhalskanker wordt veroorzaakt door het humaan papillomavirus (HPV). Het HPV virus kan met PCR (polymerase chain reaction) worden aangetoond in een cervicale uitstrijk. Voor de detectie van HPV in uitstrijken wordt gebruikt gemaakt van de BD Onclarity Assay op de BD Viper LT. Dit is een klinische gevalideerde HPV test (CE-IVD) waarmee de volgende 14 HPV typen kunnen worden gedetecteerd: 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 66 en 68. Enkele van deze HPV typen worden in drie groepen gedetecteerd: P1 (33, 58), P2 (35, 39, 68) en P3 (56, 59, 66). De test wordt ingezet als bij cytologisch onderzoek van de uitstrijk een morfologische afwijking wordt gevonden. Daarnaast heeft het moleculaire laboratorium een eigen PCR test ontwikkeld welke voornamelijk wordt gebruikt voor detectie van HPV in formaline gefixeerd materiaal. Het bijzondere ten opzichte van andere bestaande testen is dat deze HPV-test precies kan uitwijzen om welk HPV-risicotype het gaat, inclusief de twee laag-risico typen HPV6 en HPV11.De volgende HPV genotypen kunnen met de test worden gedetecteerd: Hoog-risico (17 typen): 16, 18, 31, 33, 35, 39, 45, 51, 52, 53, 56, 58, 59, 66, 68, 73 en 82 Laag-risico (2 typen): 6 en 11 De test is gebaseerd op een kwantitatieve multiplex PCR (qPCR) methode, waarbij als klinische drempelwaarde voor HPV-positiviteit een Ct-waarde kleiner dan 33,0 wordt gebruikt (Ct<33,0).
Overzicht bepalingen moleculaire diagnostiek
Het laboratorium voor pathologie (LabPON) streeft ernaar om alle benodigde moleculaire diagnostiek zo veel mogelijk op het eigen laboratorium uit te voeren. In enkele gevallen wordt het onderzoek uitbesteed, bijvoorbeeld als het gaat om bepalingen die weinig voorkomen of waar zeer specialistische kennis voor nodig is. In de onderstaande tabel wordt een overzicht weergegeven van de moleculaire bepalingen die op het moleculaire laboratorium worden uitgevoerd.